Začiatok 20. storočia bol pre vedy veľmi priaznivým obdobím. Okrem Ernesta Rutherforda a Nielsa Bohra, ktoré sa narodili v štandardnom modeli časticovej fyziky, to bolo tiež obdobím prielomov v oblasti kvantovej mechaniky. Vďaka prebiehajúcim štúdiám o správaní sa elektrónov začali vedci navrhovať teórie, podľa ktorých sa tieto elementárne častice správali spôsobom, ktorý sa vzpieral klasickej newtonovskej fyzike.
Jedným takýmto príkladom je model elektrónového cloudu, ktorý navrhol Erwin Schrodinger. Vďaka tomuto modelu sa elektróny už nezobrazovali ako častice pohybujúce sa okolo centrálneho jadra na pevnej obežnej dráhe. Namiesto toho Schrodinger navrhol model, podľa ktorého by vedci mohli robiť len vzdelané odhady, pokiaľ ide o polohy elektrónov. Preto ich umiestnenie bolo možné opísať iba ako súčasť „mraku“ okolo jadra, kde sa pravdepodobne nachádzajú elektróny.
Atómová fyzika do 20. storočia:
Najstaršie známe príklady atómovej teórie pochádzajú zo starovekom Grécku a Indii, kde filozofi ako Demokritus predpokladali, že všetka hmota sa skladá z malých, nedeliteľných a nezničiteľných jednotiek. Termín „atóm“ bol vytvorený v starovekom Grécku a dal vznik škole myšlienok známej ako „atomizmus“. Táto teória však bola skôr filozofickým než vedeckým.
Teória atómov sa stala vedeckou vecou až v 19. storočí, pričom sa uskutočnili prvé experimenty založené na dôkazoch. Napríklad začiatkom 18. storočia anglický vedec John Dalton použil koncept atómu na vysvetlenie, prečo chemické prvky reagovali určitými pozorovateľnými a predvídateľnými spôsobmi. Prostredníctvom série experimentov zahŕňajúcich plyny, Dalton pokračoval vo vývoji toho, čo je známe ako Daltonova atómová teória.
Táto teória sa rozšírila o zákonoch konverzácie hmoty a určitých rozmerov a zostúpila do piatich priestorov: prvky vo svojom najčistom stave pozostávajú z častíc nazývaných atómy; atómy špecifického prvku sú všetky rovnaké až po posledný atóm; atómy rôznych prvkov je možné rozoznať podľa ich atómových hmotností; atómy prvkov sa spoja, aby vytvorili chemické zlúčeniny; atómy nemôžu byť vytvorené ani zničené chemickou reakciou, iba zoskupenie sa stále mení.
Objav elektrónu:
Koncom 19. storočia vedci tiež začali teoretizovať, že atóm bol tvorený viac ako jednou základnou jednotkou. Väčšina vedcov sa však odvážila, že touto jednotkou bude veľkosť najmenšieho známeho atómu - vodíka. Do konca 19. storočia sa jeho drasticky zmenil vďaka výskumu vedcov, ako je Sir Joseph John Thomson.
Prostredníctvom série experimentov s použitím trubíc s katódovým žiarením (známych ako Crookesova trubica) Thomson pozoroval, že katódové lúče sa môžu odraziť elektrickými a magnetickými poľami. Dospel k záveru, že namiesto toho, aby boli zložené zo svetla, boli vyrobené z negatívne nabitých častíc, ktoré boli 1ooo krát menšie a 1800 krát ľahšie ako vodík.

Toto efektívne vyvrátilo predstavu, že atóm vodíka je najmenšia jednotka hmoty, a Thompson šiel ďalej naznačovať, že atómy sú deliteľné. Na vysvetlenie celkového náboja atómu, ktorý pozostával z kladných aj záporných nábojov, navrhol Thompson model, v ktorom boli záporne nabité „krvinky“ rozdelené do rovnomerného mora pozitívneho náboja - známeho ako slivkový pudingový model.
Tieto telieska by sa neskôr pomenovali „elektróny“ na základe teoretickej častice, ktorú predpovedal anglo-írsky fyzik George Johnstone Stoney v roku 1874. Z tohto dôvodu sa zrodil slivkový pudingový model, ktorý sa veľmi podobal anglickej púšti, ktorá pozostáva z slivkový koláč a hrozienka. Tento koncept bol predstavený svetu v marci 1904 vo Veľkej Británii Filozofický časopis, široko uznávať.
Vývoj štandardného modelu:
Nasledujúce experimenty odhalili množstvo vedeckých problémov s modrom slivkového pudingu. Pre začiatočníkov bol problém preukázať, že atóm mal jednotný pozitívny náboj na pozadí, ktorý sa stal známym ako „Thomsonov problém“. O päť rokov neskôr by bol tento model vyvrátený Hansom Geigerom a Ernestom Marsdenom, ktorí uskutočnili sériu experimentov s použitím alfa častíc a zlatých fólií - aka. „experiment so zlatou fóliou“.
V tomto experimente Geiger a Marsden zmerali rozptylový obrazec alfa častíc pomocou fluorescenčnej obrazovky. Keby bol Thomsonov model správny, alfa častice by bez prekážok prešli atómovou štruktúrou fólie. Namiesto toho však poznamenali, že zatiaľ čo väčšina zastrelila priamo, niektoré z nich boli rozptýlené rôznymi smermi, z ktorých niektoré sa vracali späť k zdroju.

Geiger a Marsden dospeli k záveru, že častice sa stretli s elektrostatickou silou oveľa väčšou, ako je sila, ktorú umožňuje Thomsonov model. Pretože alfa častice sú iba jadrá hélia (ktoré sú pozitívne nabité), znamená to, že kladný náboj v atóme nebol široko rozptýlený, ale koncentrovaný v malom objeme. Okrem toho skutočnosť, že tie častice, ktoré sa neodchyľujú, prechádzajú bez prekážok, znamenalo, že tieto pozitívne priestory boli oddelené obrovskými zálivami prázdneho priestoru.
V roku 1911 interpret Ernest Rutherford interpretoval Geiger-Marsdenove experimenty a zamietol Thomsonov model atómu. Namiesto toho navrhol model, v ktorom atóm pozostával prevažne z prázdneho priestoru, ktorého všetok kladný náboj sa sústredil v jeho strede vo veľmi malom objeme, ktorý bol obklopený oblakom elektrónov. Toto sa stalo známe ako Rutherfordov model atómu.
Následné experimenty Antoniusa Van den Broeka a Nielsa Bohra model vylepšili. Zatiaľ čo Van den Broek naznačil, že atómové číslo prvku je veľmi podobné jeho jadrovému náboju, druhý navrhol model atómu podobného slnečnej sústave, kde jadro obsahuje atómové číslo kladného náboja a je obklopené rovnakým počet elektrónov v orbitálnych škrupinách (známy ako Bohrov model).
The Electron Cloud Model:
V 20. rokoch 20. storočia bol rakúsky fyzik Erwin Schrodinger fascinovaný teóriami Maxom Planckom, Albertom Einsteinom, Nielsom Bohrom, Arnoldom Sommerfeldom a ďalšími fyzikmi. Počas tejto doby sa tiež zapájal do oblasti atómovej teórie a spektra, výskumoval na univerzite v Zürichu a potom na univerzite Friedricha Wilhelma v Berlíne (kde v roku 1927 nahradil Plancka).

V roku 1926 sa Schrödinger zaoberal otázkou vlnových funkcií a elektrónov v rade článkov. Okrem opisu toho, čo by sa stalo známym ako Schrodingerova rovnica - parciálna diferenciálna rovnica, ktorá opisuje, ako sa kvantový stav kvantového systému mení s časom - použil matematické rovnice na opísanie pravdepodobnosti nájdenia elektrónu v určitej polohe. ,
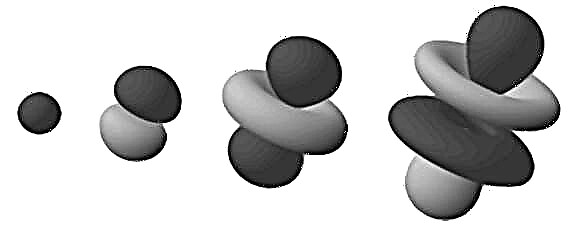
Toto sa stalo základom toho, čo by sa stalo známym ako model elektrónového oblaku (alebo kvantového mechanického modelu), ako aj Schrodingerovej rovnice. Na základe kvantovej teórie, ktorá uvádza, že všetka hmota má vlastnosti spojené s vlnovou funkciou, sa model elektrónového oblaku líši od modelu Bohrovho modelu tým, že nedefinuje presnú cestu elektrónu.
Namiesto toho predpovedá pravdepodobnú polohu polohy elektrónu na základe funkcie pravdepodobností. Funkcia pravdepodobnosti v podstate popisuje oblasť podobnú oblaku, kde je pravdepodobné, že sa elektrón nájde, odtiaľ názov. Ak je oblak najhustejší, pravdepodobnosť nájdenia elektrónu je najväčšia; a tam, kde je elektrón menej pravdepodobný, je oblak menej hustý.
Tieto husté oblasti sú známe ako „elektrónové orbitaly“, pretože sú najpravdepodobnejším miestom, kde sa nachádza obiehajúci elektrón. Po rozšírení tohto „cloudového“ modelu na trojrozmerný priestor vidíme atóm v tvare činky alebo kvetu (ako na obrázku hore). Odvetvovacie oblasti sú oblasti, v ktorých najpravdepodobnejšie nájdeme elektróny.
Vďaka Schrodingerovej práci vedci začali chápať, že v oblasti kvantovej mechaniky nebolo možné poznať presnú polohu a hybnosť elektrónu súčasne. Bez ohľadu na to, čo pozorovateľ na začiatku vie o častici, môže predpovedať svoju budúcu polohu alebo hybnosť iba z hľadiska pravdepodobnosti.
V žiadnom danom čase nebudú schopní zistiť ani jednu. V skutočnosti, čím viac vedia o hybnosti častice, tým menej budú vedieť o svojej polohe a naopak. Toto sa dnes nazýva „zásada neistoty“.
Všimnite si, že orbitaly uvedené v predchádzajúcom odseku sú tvorené atómom vodíka (t. J. Iba s jedným elektrónom). Pri práci s atómami, ktoré majú viac elektrónov, sa obežné dráhy elektrónov rovnomerne rozložia do sférickej fuzzy gule. Tu je najvhodnejší termín „elektrónový mrak“.
Tento príspevok bol všeobecne uznávaný ako jeden z nákladovo dôležitých príspevkov 20. storočia a príspevok, ktorý vyvolal revolúciu v oblasti fyziky, kvantovej mechaniky a skutočne všetkých vied. Odvtedy vedci už nepracovali vo vesmíre charakterizovanom absolútnymi časmi a priestorom, ale v kvantových neistotách a relativite časopriestoru!
Tu sme napísali veľa zaujímavých článkov o atómoch a atómových modeloch tu v časopise Space Magazine. Čo je atómový model Johna Daltona ?, Čo je to model slivkového pudingu?
Ďalšie informácie nájdete v časti Čo je kvantová mechanika? od Live Science.
Astronómia Cast má tiež epizódu na túto tému, napríklad Epizóda 130: Rádio astronómia, Epizóda 138: Kvantová mechanika a Epizóda 252: Heisenbergov princíp neistoty.