Už dlho je známe, že všetky molekuly majú dva rovnaké a opačné náboje, ktoré sú oddelené určitou vzdialenosťou. V prípade takýchto polárnych molekúl sa centrum záporného náboja nezhoduje so stredom kladného náboja. Rozsah polarity v týchto kovalentných molekulách sa môže opísať výrazom Dipole Moment, ktorý je v podstate mierou polarity v polárnej kovalentnej väzbe.
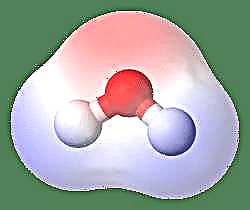
Najjednoduchším príkladom dipólu je molekula vody. Molekula vody je polárna kvôli nerovnomernému zdieľaniu jej elektrónov v „ohnutej“ štruktúre. Molekula vody tvorí uhol s atómami vodíka na špičkách a kyslíkom vo vrchole. Pretože kyslík má vyššiu elektronegativitu ako vodík, má strana molekuly s atómom kyslíka čiastočný záporný náboj, zatiaľ čo vodík v strede má čiastočný kladný náboj. Z tohto dôvodu smer dipólového momentu ukazuje na kyslík.
V jazyku fyziky je elektrický dipólový moment mierou oddelenia pozitívnych a negatívnych elektrických nábojov v systéme nábojov, to znamená mierou celkovej polarity nábojového systému - tj separáciou elektrického náboja molekúl, čo je vedie k dipólu. Matematicky a v jednoduchom prípade dvojbodového náboja, jedného s nábojom + q a jedného s nábojom q, možno elektrický dipólový moment p vyjadriť ako: p = qd, kde d je vektor posunu smerujúci od záporného náboja k kladný náboj. Vektor elektrického dipólového momentu p teda smeruje od záporného náboja k kladnému náboju.
Ďalším spôsobom, ako sa na to pozrieť, je reprezentovať Dipólový moment gréckym písmenom m, m = ed, kde e je elektrický náboj a d je vzdialenosť oddelenia. Vyjadruje sa v jednotkách Debye a píše sa ako D (kde 1 Debye = 1 x 10-18e.s.u cm). Dipólový moment je množstvo vektora, a preto je predstavované malou šípkou s chvostom v kladnom strede a hlavou smerujúcou k zápornému stredu. V prípade molekuly vody je dipólový moment 1,85 D, zatiaľ čo molekula kyseliny chlorovodíkovej je 1,03 D a môže byť vyjadrená ako:
Napísali sme veľa článkov o dipólovom momente pre časopis Space Space. Tu je článok o tom, z čoho je voda vyrobená, a tu je článok o molekulách.
Ak chcete získať viac informácií o dipólovom okamihu, pozrite si tieto články od spoločnosti Hyperphysics and Science Daily.
Zaznamenali sme tiež celú epizódu Obsadenia astronómie o Molekulách vo vesmíre. Počúvajte tu, Episode 116: Molecules in Space.
zdroj:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule